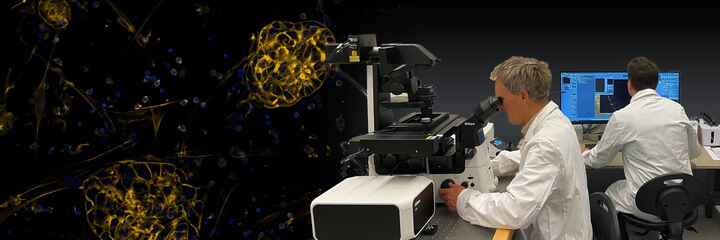
A1 MP+ / A1R MP+ Multiphoton
Microscope confocal multiphotonique de haute définition
Suspendu Replaced by AX R MP with NSPARC
Incroyablement profond — A1R MP+ détecte les dynamiques ultra profondes au sein des organismes vivants.
Les microscopes confocaux multi-photons A1R MP+ permettent une imagerie plus rapide et plus précise ddes organismes vivants, étendant les limites des techniques traditionnelles de recherche en sciences biologiques. Ils sont compatibles avec les microscopes verticaux et inversés et fournissent des configurations d'imagerie multi-photonique optimale pour la recherche sur le cerveau, d'autres applications en neurosciences et l'imagerie in vivo de spécimens vivants.